さまざまな病気の原意となる内在性酸化ストレス、環境を再現できるヒトモデル細胞が必須
九州大学は7月6日、ヒトiPS細胞を用いて分化のどの段階でも任意の量の酸化ストレスを制御できる新しいシステムを開発し、内胚葉系への初期分化段階で細胞内の酸化ストレスを増加させると、転写因子FOXC1の一過性の発現増加を介して内胚葉分化が抑制されることを見出したと発表した。この研究は、同大大学院医学研究院基礎放射線医学分野の岡素雅子客員研究員(筆頭・責任著者)、大野みずき助教の研究グループによるもの。研究成果は、「Cell Death Discovery」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
生体内において、酸素の90%は細胞内小器官のミトコンドリアで消費される。そのうち1~5%がミトコンドリアにおける細胞内呼吸に伴って活性酸素種ROSとして変換される。ROSは細胞の分化や増殖に重要な役割を持っている。一方、細胞内で過剰に漏出したROSが幹細胞分化を阻害することが示唆されることから、細胞が正常な分化運命を辿り組織を構築していくためにはROS生成量の精密な制御が重要であると考えられる。ROSは、加齢とともに起きるミトコンドリア機能不全や抗酸化酵素活性の低下により増加していく。生じた過剰なROSが細胞の分化や増殖を損なうことで神経変性疾患や発がんの原因になることが示唆されている。以上により、細胞運命におけるROSの役割を明らかにすることは極めて重要だ。
これまで、ROSの研究は主に細胞外からROS誘導剤や抑制剤を投与する方法が用いられてきた。しかし、ROSは主に細胞の生命活動に伴って増加するものであることから、内在性のROS生成をコントロールして細胞内環境を再現するヒトモデル細胞の構築が必須となる。
ROSを増加させるタンパク質と分解する酵素の両方をヒトiPS細胞内で任意に制御可能に
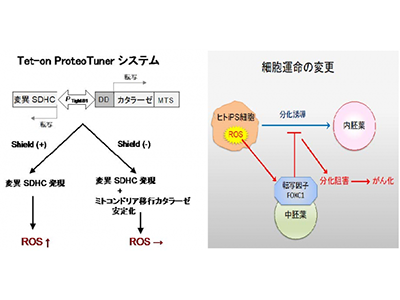
ミトコンドリアの呼吸鎖複合体IIは4つのタンパク質SDHA、SDHB、SDHC、SDHDにより構成されている。このコハク酸-ユビキノン酸化還元酵素をコードするSDHC遺伝子は、家族性パラガングリオーマの原因遺伝子として報告されている。マウスにおいてミトコンドリアのSDHC変異(I69E)タンパク質を発現させると、ミトコンドリアの複合体IIの機能不全を介してROS産生が増加し、胎児発育遅延がおきることが報告されている。
研究グループは、Tet-on ProteoTuner遺伝子発現誘導システムを用いて、ROSを増加させるSDHC変異(I69E)タンパク質と、ROSを分解する酵素カタラーゼの両方の発現を細胞内でコントロールできる、ヒトiPS細胞株を樹立した。この系により、ヒトiPS細胞がさまざまな胚葉系に分化する任意の段階で、任意の量のROSを産生、消去させることができる。
分化初期の酸化ストレス、FOXC1を介して内胚葉分化を抑制し細胞運命を変化
研究グループは、この系を用いて内胚葉への初期分化段階で細胞内のROS量を増加させた。すると、転写因子FOXC1の発現が増加し、内胚葉への分化が抑制されることを見出した。さらに分化早期の段階でFOXC1発現を抑制すると内胚葉分化は改善したという。
FOXC1は早期中胚葉の分化段階で発現している因子である一方、肝細胞がんや膵がん、大腸がんなどのがんで発現が増加しており、がん細胞の増殖や転移に重要な役割をもつことが知られている。研究グループは、この細胞がマウスにおいて腫瘍形成能を持つことを報告している。異なる胚葉マーカーの発現が予定された分化の方向を抑制することが知られていることから、ROSが中胚葉マーカーFOXC1発現を介して内胚葉への分化運命を変えることで、がん化を引き起こすことが示唆された。
酸化ストレス関連の病気、発がんなどのメカニズム解明と治療法開発に期待
分化阻害による細胞運命の転換は、発がんと強い関わりがある。がん幹細胞は正常な幹細胞と比較すると、分化能が限られていることが知られており、がん化能をもつ幹細胞において、その分化能を回復させることでがん化を効果的に予防することが期待できる。研究グループが樹立したヒトiPS細胞株は、肝細胞、膵臓β細胞、心筋細胞や神経前駆細胞など多種の細胞に分化誘導することができることができる。
同研究で確立したシステムを用いることで、分化初期の過剰なROSにより引き起こされるシグナルを明らかにし、酸化ストレス関連の病気のメカニズム解明とその新たな治療の開発を目指す、と研究グループは述べている。
▼関連リンク
・九州大学 研究成果






