病原性細菌の抗生物質耐性持続性に関与の「TAモジュール」
東京大学は12月22日、病原性細菌の一種であるサルモネラ菌(Salmonella Typhimurium)のパーシスター細胞の形成誘導に関与するTacTタンパク質が、特定のアミノアシルtRNAをアセチル化修飾し、それによりタンパク質合成を阻害する分子機構を明らかにしたと発表した。この研究は、同大大学院新領域創成科学研究科メディカル情報生命専攻の八代悠歌特任研究員、張楚翹氏(研究当時)、富田耕造教授らの研究グループが、同大大学院工学系研究科化学生命工学専攻の鈴木勉教授らとの共同研究として行ったもの。研究成果は、「Cell Reports」にオンライン掲載されている。
画像はリリースより
トキシン-アンチトキシン(Toxin-Antitoxin:TA)モジュールは、トキシンとアンチトキシンの遺伝子対からなるオペロンで、多くの細菌に存在する。通常の生理的条件下では、トキシンの活性・機能は、アンチトキシンによって抑制されている。細菌が環境ストレスを受けると、アンチトキシンは分解されるため、トキシン活性抑制が解除されて、活性化する。TAモジュールに含まれるトキシンの活性は多岐にわたり、DNA複製、転写、翻訳、細胞壁合成など細菌の細胞内での必須プロセスを阻害し、細菌の増殖停止を引き起こし、細菌は休眠状態(dormancy)に入る。TAモジュールは、細菌がストレス環境下で細菌自身の増殖を抑制し、休眠・活動休止を誘導することにより、さまざまな環境条件下で生存していくためのシステムであると考えられている。また、病原性細菌のTAモジュールは、抗生物質にさらされた細菌のごく一部が遺伝子の変化を伴わずに抗生物質耐性を示す細菌の抗生物質耐性持続性(Persistence:パーシスタンス)に関与していることも示唆されている。
サルモネラ菌ではGNATトキシン「TacT」が耐性に関与、そのメカニズムは?
最近発見された細菌のパーシスタンスに関与するGNAT(GCN5-related acetyltransferase)トキシンは、アセチルCoAをアセチル基供与体とし、アミノアシルtRNAのアミノアシル部位のαアミノ基をアセチル化することによりタンパク質合成を阻害する。GNATトキシンは、2016年に初めてサルモネラ菌において同定された。サルモネラ菌、Salmonella TyphimuriumとS. Enteritidisのゲノムには、TacT、Tac2、TacT3の3つのGNATトキシン遺伝子が存在する。それぞれのGNATトキシン遺伝子の欠失によって、マクロファージ内でのサルモネラ菌のパーシスター細胞の形成(パーシスタンスを示す細菌細胞をパーシスター(persister)細胞と呼ぶ)が抑制されることから、GNATトキシンがマクロファージ感染時のサルモネラ菌のパーシスター細胞形成を促進し、その結果、感染症の薬剤抵抗性、感染症の再発につながることが明らかになった。
アミノアシルtRNAを標的とする同様なGNATトキシンは腸管出血性大腸菌や肺炎棹菌、赤痢菌などの病原性細菌にも存在し、それぞれのGNATトキシンの標的アミノアシルtRNAも多様性に富んでいることが報告されている。しかし、これらのGNATトキシンの特異性の分子基盤については明らかになっていなかった。
TacTは一種類のアミノアシルtRNAのみをアセチル化すると判明
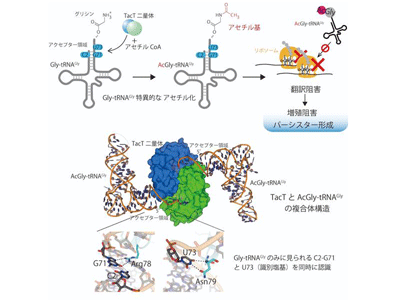
今回、研究グループは、サルモネラ菌のトキシンTacTに注目。まず、TacTの標的となる細菌内アミノアシルtRNAを質量分析で解析したところ、細菌内でのTacT発現誘導によって、20種類存在するアミノアシルtRNAのうちグリシンを受容したtRNAGly(Gly-tRNAGly)のみが唯一アセチル化を受けることがわかった。さらに、試験管内で各種アミノアシルtRNAのアセチル化の生化学解析を行った結果、TacTはGly-tRNAGlyを他のアミノアシルtRNAと比較して、酵素学的に数十倍以上効率よくアセチル化することがわかった。よって、TacTはGly-tRNAGlyを特異的にアセチル化する酵素であることが明らかになった。
次に、TacTによるGly-tRNAGlyの特異的アセチル化の詳細な分子基盤を明らかにするため、TacTとアセチル化されたGly-tRNAGly(AcGly-tRNAGly)の複合体の三次元構造をX線結晶構造解析にて決定した。二量体TacTに2分子のtRNAが結合し、TacT二量体分子のサブユニット接触境界領域にまたがってtRNAGlyのアクセプター領域が結合することがわかった。TacTはtRNAGlyのみに見出されるU73(識別塩基)とアクセプター内のC2-G71の両方を特異的に認識していることが明らかになった。tRNAの変異体を用いた生化学的解析、TacT変異体の細菌内での機能解析により、TacTがtRNAGlyのみに見られる上記特異的な塩基配列を認識しているだけでなく、3′末端に受容しているアミノ酸の大きさも識別していることも明らかになり、TacTのGly-tRNAGly特異的、かつ選択的なアセチル化の詳細な分子基盤の詳細が明らかになった。
TacTのアセチル化活性阻害など、新しいタイプの薬剤開発に期待
同様なGNATトキシンは他の多くの病原性細菌においても報告されているが、それらの特異性は未だに明らかにされていない。今回、サルモネラ菌のTacTがGly-tRNAGlyを特異的、選択的にアセチル化する分子機構が明らかにされたが、特異的なGly-tRNAGlyのアセチル化によるタンパク質合成の阻害とサルモネラ菌のパーシスター細胞形成の関係については、今後の解析が待たれる。また、「病原菌由来のGNATトキシンの詳細な基質認識の分子機構やGNATトキシンの特異性の差異の分子基盤を明らかにすることにより、食中毒、感染症の原因となる病原性細菌の休止状態や薬剤耐性獲得プロセスを阻害し、病原性細菌の抗生物質に対する感受性を増幅する新たな薬剤の開発への技術的基盤の提供が期待できる」と、研究グループは述べている。
▼関連リンク
・東京大学大学院新領域創成科学研究科 記者発表




