キメラ型siRNAとYBCからなる革新的な核酸医薬の開発
慶應義塾大学は4月20日、乳がんおよび膵がんで発現が亢進している転写因子PRDM14遺伝子を標的とする、配列特異性の高い「キメラ型siRNA」と核酸を病変に送達する「Y-shaped block co-polymer」(YBC)からなる核酸医薬候補の開発に成功したこと、ならびに、再発乳がん患者に対する医師主導治験(第Ⅰ相)が現在進行中であることを発表した。この研究は、同大医学部臨床研究推進センターの谷口博昭特任准教授(東京大学医科学研究所分子療法分野客員准教授)、同医学部の名取幸和客員研究員(大阪大学医学系研究科招聘教授)、神奈川県立がんセンター臨床研究所の宮城洋平所長、ナノ医療イノベーションセンターの林光太郎研究員、東京大学医科学研究所先端医療開発推進分野の長村文孝教授、ナノ医療イノベーションセンターの片岡一則センター長(東京大学名誉教授)、北海道大学遺伝子病制御研究所の今井浩三客員教授の研究グループによるもの。研究成果は「International Journal of Cancer」に掲載されている。
画像はリリースより
乳がんにおいてPRDM14分子の発現が特に高いことが、札幌医科大学の豊田実氏(故人)らによって発見された。その後、PRDM14分子が膵がん等の悪性腫瘍においても発現が高く、がん幹細胞性形質(抗がん剤耐性、転移・浸潤、血管新生等)を腫瘍細胞に付与することが見出された。PRDM14分子は、がん組織にのみ発現し、正常細胞で発現を認めないことから、がん治療の良い分子標的になることが想定されていた。
PRDM14分子が核内転写因子であることから、研究グループは、遺伝子情報から創薬が可能である核酸創薬に着手。目標は、治癒的切除ができない患者を対象とした静注投与による全身投与法の創出とした。核酸医薬のハードルを克服するため、核酸、およびそのデリバリーシステムに関して革新的な技術の適用を検討した。具体的には、東京大学大学院理学研究科で開発された、極めて安全性・血中安定性が高く十分なRNA干渉効果が得られるキメラ型siRNAを用い、また、siRNA配列探索プログラムを基盤に、off target効果を排除した治療用配列を選定した。さらに、東京大学大学院工学系研究科、ナノ医療イノベーションセンターで開発された核酸ナノキャリアであるYBCを用いることにした。YBCは、ポリオルニチンとポリエチレングリコール(PEG)から構成され原材料の安全性の懸念がなく、優れた血中滞留性を示し、EPR効果によりがん組織への高い集積性を示す。
モデルマウスへの投与で腫瘍径の増大抑制、遠隔転移モデルでも生存期間の延長
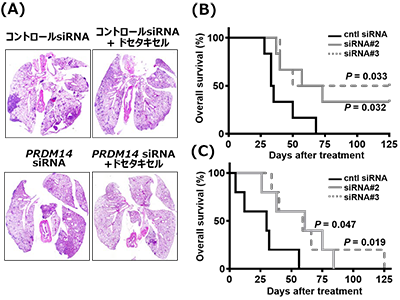
PRDM14siRNA核酸医薬候補の治療効果を評価するため、難治性であるトリプルネガティブ乳がん、および膵がんより樹立されたPRDM14分子陽性のがん細胞株を用いた動物モデルを作製した。同モデルに静注投与した結果、乳がん同所移植モデル、膵がん皮下移植モデルの双方において、腫瘍径の増大を抑制し、その効果は抗がん剤との併用で相乗的な治療効果を示した。さらに、遠隔転移モデルに適用したところ、転移巣の減少、生存期間の延長が認められたという。
また、YBCの先行型である、分岐型PEG-poly(L-lysine)と比較して、分岐型PEG-poly(L-ornithine)を用いることにより、より少量のポリマーにて同等の治療効果が得られることも判明した。
再発乳がん患者に対するP1試験が進行中
安全性試験(非臨床試験)において重篤な有害事象は認められなかったことから、2020年9月より、がん研究会有明病院において、治癒的切除不能または遠隔転移のある再発乳がん患者に対する同核酸医薬候補の医師主導治験(第Ⅰ相)が進められている。
▼関連リンク
・慶應義塾大学 プレスリリース



