がん細胞や生殖細胞内で転移し続けるLINE-1について研究
京都大学は8月29日、「がらくたDNA」の一種であり、自らのDNA配列を移動させる転移因子LINE-1の転移に関わるメカニズムを明らかにしたと発表した。この研究は、同大大学院生命科学研究科の三好知一郎准教授、牧野竹志修士課程学生が、米ミシガン大学のJohn Moran教授と共同で行ったもの。研究成果は、国際学術誌「Molecular Cell」のオンライン版に掲載されている。
画像はリリースより
生物のDNA配列の中には、「がらくたDNA」とも呼ばれる、まだ存在意義のよくわからない配列が多く存在している。がらくたDNAは潜在的に細胞の恒常性、寿命・発生・分化過程、あるいはある疾患へのかかりやすさなど、今後の生命科学においてパラダイムシフトにつながるさまざまな情報を含んでいると考えられている。ほとんどの生物のがらくたDNAの中には「転移因子」とよばれる配列が存在し、DNA上のある場所から別の場所へと移動するという性質をもっている。ヒトでは約45%のDNA配列が転移因子から構成されているが、それらのほとんどは太古の昔に転移した残骸や既に転移する能力を失った配列として残されている。しかしLINE-1やSINEと呼ばれる配列の一部は、現在でも生殖細胞、発生の初期段階、神経前駆細胞やがん細胞内で転移し続けており、転移の分子メカニズムはまだよくわかっていない。転移因子の存在は集団内の遺伝的多様性を生み出す原動力になり生物の進化を促すと考えられる一方で、短期的には疾患の原因となるDNA変異を生み出すことになる。
PARP2がセンサーとなりLINE-1が転移先のDNAに入り込む
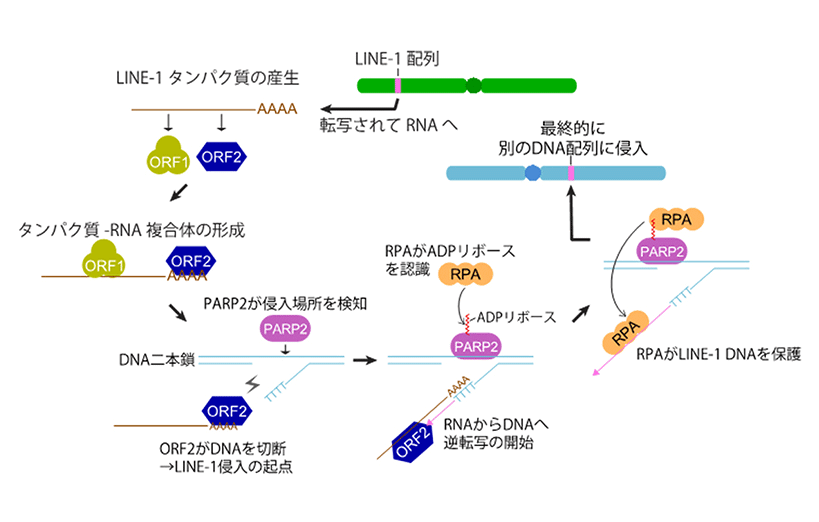
LINE-1は転移因子の中でもレトロトランスポゾンと呼ばれる配列で、DNAからRNAに転写された後、再びDNAに逆転写されて別のDNA配列中に侵入するという様式を用いている。このためLINE-1はコピー&ペースト方式によってDNA内を増幅転移する。ヒトではLINE-1が全DNA配列中の約17%程度を占めているが、研究グループはこの中でも特に活発に移動している特定のLINE-1配列を選択して発現ベクターに組み込み、ヒト細胞で高発現させる実験系を構築した。LINE-1は転移する際に2つのタンパク質ORF1とORF2を作り出す。特にORF2はDNAを切断するエンドヌクレアーゼ活性と、LINE-1のRNAをDNAに逆合成する逆転写酵素活性をもつことがわかっているため、転移する際のキープレイヤーであると予想される。そこでORF2と結合する細胞内タンパク質の中に、転移を制御する分子が含まれていると考え、これらを網羅的に同定することを試みた。
まず、ヒト培養細胞にLINE-1発現ベクターを導入し、抗体を用いてこの細胞内からORF2タンパク質だけを分離精製した後、質量分析装置によってORF2と一緒に精製されるタンパク質の同定を試みたところ、さまざまなタンパク質が同定された。LINE-1のDNA侵入はORF2によるDNA切断から開始されるため、これらの中からDNA修復タンパク質のPARP1とPARP2に着目して解析を進めた。その結果、両者を遺伝子ノックダウンによって機能低下させた細胞では、LINE-1の転移効率が著しく低下することが判明した。また特にPARP2は、ORF2がDNAを切断する際に、この場所を特異的に認識して結合するセンサータンパク質であることも生化学的な手法から明らかとなった。
LINE-1は細胞内のDNA修復タンパク質群と連携して効率よく転移
PARPタンパク質はADPリボースという化学修飾を自分自身や周囲にあるタンパク質に付け加える役割があり、これが目印となってさらに別のDNA修復タンパク質群がDNA損傷部位に呼び込まれて修復を促進すると考えられている。そこでPARP2によって損傷部位にリクルートされる他のタンパク質を探索したところ、これまでADPリボースと直接の接点が分かっていなかったRPAというタンパク質が呼び込まれることも新たにわかった。
RPA遺伝子をノックダウンした細胞でも、PARP1やPARP2のノックダウン細胞同様、LINE-1の転移効率が減少していた。さらにRPAは、LINE-1のRNAがDNAへと逆転写される際、このDNA部分を保護安定化することでLINE-1の転移を促進することも突き止められた。以上のように、LINE-1が細胞内のDNA修復タンパク質群と連携することで効率の良い転移につながることが判明した。
LINE-1の転移によるがん化などを防ぐ手法の開発に期待
LINE-1の無秩序な転移は、DNAに損傷を蓄積させて細胞を死に追いやるだけでなく、個体の生存をおびやかす疾患原因にもなりうるため、生物は長い年月をかけてこのパラサイトDNAの転移を抑える防御メカニズムを構築してきたと考えられる。これはLINE-1の転写抑制やRNA分解制御などで行われることが明らかになりつつあるが、抑制効果は100%ではない。それは現生人類を含め、さまざまな生物では今でも転移因子が活発に移動していることからも明らかだが、ひとたび防御機構を逃れたLINE-1がどうやってその転移効率を維持しているのか、長い間未解明だった。
今回の研究成果から、ヒトだけでなく多くの生物種でも、実はLINE-1が宿主タンパク質、特にPARPファミリータンパク質を利用して巧妙に転移していると予想される。哺乳類の生殖細胞、初期胚、神経前駆細胞では比較的LINE-1が高発現していると考えられている。異常に高発現した場合は細胞死が起こることを示唆する報告もあり、今後、種々の疾患につながるDNA変異、あるいはがん細胞の悪性化などを含め、さまざまな局面でLINE-1が及ぼす負の効果を打ち消すような手法の開発へとつながることが期待される。一方で、この研究ではPARPファミリーだけではなく多様な宿主タンパク質がLINE-1の制御を行っていることも示唆された。「LINE-1転移メカニズムの全貌解明には、さらに継続した研究が必要である」と、研究グループは述べている。
▼関連リンク
・京都大学 研究成果






