アレルギー治療薬などのターゲットとして注目されるTLR9
東京大学は4月6日、微生物の侵入を感知して免疫系を活性化するタンパク質「Toll様受容体9(TLR9)」の新しいDNA結合部位を明らかにしたと発表した。この研究は、同大大学院薬学系研究科の大戸梅治准教授、石田英子特任研究員、清水敏之教授、同大医科学研究所の柴田琢磨助教、三宅健介教授らの研究グループによるもの。研究成果は米科学雑誌「Immunity」に掲載されている。
画像はリリースより
細菌やウイルスなどの病原体に対する感染防御機構として、ヒトの体には自然免疫機構が備わっており、TLR受容体はその役割を担う主要なセンサーのひとつ。DNA中に存在するシトシンとグアニンがホスホジエステル結合でつながった配列はCpGモチーフと呼ばれ、哺乳類ではメチル化されることが多いのに対して、細菌やウイルスではメチル化されないことがわかっている。微生物由来の非メチル化CpGモチーフはTLR9を強く活性化してインターフェロンなどの産生を促し、抗ウイルス反応などを引き起こす。そのため、TLR9はウイルス感染やアレルギーに対する治療薬やワクチンのアジュバントなどのターゲットとして注目されている。
研究グループはこれまでに、CpGモチーフが結合した状態のTLR9の構造解析に成功していた。しかし、CpGモチーフだけではTLR9を十分活性化することはできず、TLR9の活性化機構には不明な点が多く残されていた。
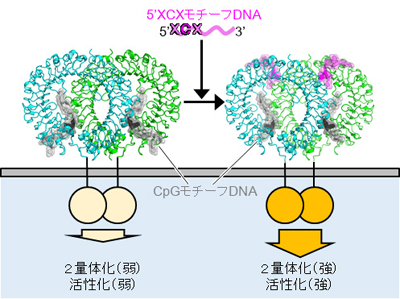
TLR9、CpGモチーフDNAと5′XCXモチーフDNAにより活性化
研究グループは、CpGモチーフに加えて、5′末端から2番目にシトシン塩基を持つDNA(5′XCXモチーフ)がTLR9に結合することを発見。TLR9にまずCpGモチーフを持つDNAが結合し、さらに5′XCXモチーフを持つDNAが結合することで、TLR9が効率的に二量体化し活性化することを明らかにしたという。また、大型放射光施設SPring-8および高エネルギー加速器研究機PhotonFactoryの強力なX線を用いて、これらの2種類のモチーフを持つDNAが結合したTLR9のX線結晶構造解析に成功。構造解析の結果、TLR9、CpGモチーフDNA、5′XCXモチーフDNAは2対2対2の比率で結合し、TLR9は活性化型の二量体構造を形成していた。さらに、5′XCXはCpGモチーフDNAとは異なる部位に結合して、その2番目のシトシン塩基部分がTLR9と多くの相互作用を形成することでTLR9の二量体を安定化させていたという。
5′XCXモチーフDNAの結合部位は、TLR7やTLR8でヌクレオシドが結合する部位に相当していたという。TLR7およびTLR8では、グアノシンやウリジンなどのヌクレオシドと一本鎖RNAがそれぞれ別の場所に結合することで活性化されることがわかっている。今回の研究により、これまでCpGモチーフDNAによって活性化すると考えられてきたTLR9が、実はCpGモチーフDNAと5′XCXモチーフDNAという2種類のDNAによって、TLR7やTLR8と同じように協調的に活性化されることが明らかとなったとしている。
今回の研究結果より、TLR9を標的とした抗ウイルス薬、抗アレルギー薬、ワクチンの開発につながることが期待される、と研究グループは述べている。
▼関連リンク
・東京大学大学院薬学系研究科・薬学部 ニュース






