運動ニューロンが細胞死に至るカスケードは、これまで未解明
東京大学は1月3日、カルパインというカルシウム依存性プロテアーゼの活性化が、核膜孔複合体(NPC)の構成因子であるヌクレオポリンを異常に切断し、核-細胞質輸送を障害することが筋萎縮性側索硬化症(ALS)の原因メカニズムであることを、分子生物学的手法により明らかにしたと発表した。この研究は、国際医療福祉大学臨床医学研究センターの郭伸特任教授(東京大学大学院医学系研究科 客員研究員)、東京大学大学院医学系研究科 脳神経医学専攻 神経病理学分野の山下雄也特任研究員らの研究グループが、東京医科大学の相澤仁志教授と共同で行ったもの。同成果は、「Scientific Reports」オンライン版に同日付けで掲載されている。
画像はリリースより
ALSには有効な治療法がなく、死に至る難病であるため、根本的な治療法が切望されている。しかし、運動ニューロンが細胞死に至るカスケードは、これまでほとんど未解明であった。同研究グループはこれまでに、ALSの病因解明研究を進めるなかで、異常なカルシウム透過性AMPA受容体の発現が病因に関わる疾患特異的分子異常であり、細胞内カルシウム濃度の異常な上昇がカルパインの活性化を通じてALS運動ニューロンに特異的にみられるTDP-43病理を引き起こすことを明らかにしていた。
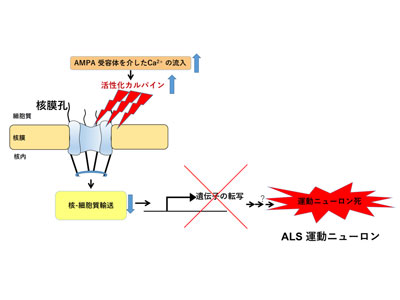
活性化カルパインが核膜孔複合体構成因子を切断し、核-細胞質輸送を障害
研究グループは、孤発性ALSの病態を示すAR2マウスを用いて、運動ニューロンが変性・脱落するカスケードの検討を実施。その結果、核と細胞質輸送に重要であるNPCの形態異常を見出し、NPCの構成因子であるヌクレオポリンが存在する核膜に形態異常や喪失を見出したという。さらにこの異常が、カルシウム依存性のプロテアーゼであるカルパインの異常な活性化によりヌクレオポリンが切断されることで引き起こされることを明らかにし、核-細胞質輸送因子も障害されていることをマウスモデルだけでなくALS患者剖検組織においても見出した。NPCの障害された運動ニューロンでは、必要な遺伝子発現が低下していることも示されたことから、これらの障害によって細胞の正常な生理活動が阻害され細胞死に陥ることが示唆されたという。
これらの変化を引き起こすのは、これまで開発してきた治療法(アデノ随伴ウイルスAAVを用いたADAR2 の遺伝子治療、AMPA 受容体アンタゴニストであるペランパネルによる薬剤療法)が標的とした分子異常であることから、これらの治療法により正常化することが示唆される。また、NPCの変化は孤発性ALSのみならず一部の家族性ALSでも報告されており、同研究グループの開発している治療法が幅広くALS患者に適用できる可能性があるという。
同研究グループは、今後は明らかになった分子異常を標的とした治療研究を進めるとともに、分子カスケー ドの上流下流を更に検索していく予定としている。
▼関連リンク
・東京大学 プレスリリース






