がん幹細胞が自分自身を維持する過程に“長鎖非翻訳RNA”が深く関与
名古屋市立大学は12月1日、タンパク質に翻訳されないRNAのうち“長鎖非翻訳RNA”と呼ばれるRNAをターゲットとした治療法が、悪性脳腫瘍に有効である可能性を培養細胞やマウスを用いた実験から明らかにしたと発表した。この研究は、同大大学院医学研究科遺伝子制御学分野の近藤豊教授と勝島啓佑助教らの研究グループが、名古屋大学、東京大学、ナノ医療イノベーションセンター、国立がん研究センター研究所らとの共同で行ったもの。同研究成果は、英科学雑誌「Nature Communications」(電子版)に12月6日付で掲載されている。
画像はリリースより
がんは “がん幹細胞”とこれに由来する多様ながん細胞から成るが、がん幹細胞の作り出すこの組織多様性は、がん治療を困難にしている一因となっており、がん幹細胞を消滅させる方法が必要とされていた。がん幹細胞が自分自身を維持する過程には、“エピゲノム” と呼ばれるシステムによる遺伝子のON/OFFの調節が重要な役割を果たしている。エピゲノムによるON/OFF調節にはタンパク質に翻訳されないRNAである“長鎖非翻訳RNA”が深く関与していることがわかってきていた。
TUG1-DDSによる治療が有効な抗腫瘍効果を示すことを確認
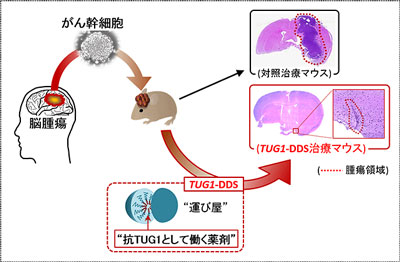
脳腫瘍のひとつであるグリオブラストーマ(膠芽腫)は、脳腫瘍の中で最も高頻度に発生するきわめて悪性度の高い腫瘍。現在、この腫瘍に対する有効な治療法はなく、新しい治療法の開発が求められている。今回の研究では、ヒト脳腫瘍からがん幹細胞を作製し、がん幹細胞の維持にかかわる長鎖非翻訳RNAの役割について詳細に解析。その結果、長鎖非翻訳RNAのひとつである「TUG1」により、がん幹細胞が維持されていることを世界で初めて明らかにしたという。
次に、“抗TUG1として働く薬剤(TUG1の機能を効率的に抑えることができる薬剤)”を作製し、がん幹細胞を移植したマウスを用いて、がん治療薬としての有効性について解析した。有効ながん治療薬を開発するためには、薬剤をがん部のみに送り届ける必要がある。そこで同研究では、ナノ医療イノベーションセンター片岡一則センター長、東京大学宮田完二郎准教授の協力のもと、薬剤をがん部のみに届けることができる“運び屋”と抗TUG1として働く薬剤を組み合わせた治療薬(TUG1-DDS)を作製。このTUG1-DDSを用いることにより、抗TUG1として働く薬剤をがん部のみに送達することに成功。さらにTUG1-DDSによる治療が有効な抗腫瘍効果を示すことを確認したという。
この研究において開発したTUG1-DDSは、膠芽腫に対する有望な治療薬になることが期待される。研究グループは、今後、さらに同治療法について副作用等を含めた解析を進め、安全性に関する試験を行い、TUG1-DDSの実用化を目指すとしている。
▼関連リンク
・名古屋市立大学 報道資料






