原因遺伝子「LRRK2」に病因変異で細胞内の小胞輸送に異常
順天堂大学は9月11日、同大大学院医学研究科 パーキンソン病病態解明研究講座の服部信孝教授、今居譲先任准教授ら、および京都大学の高橋良輔教授らの研究グループが、晩発性パーキンソン病で神経変性がゆっくり進行するメカニズムを解明したと発表した。研究成果は、同日付で科学誌「PLoS Genetics」オンライン版に発表されている。
画像はリリースより
2004年、パーキンソン病を頻発する家系の解析から「LRRK2遺伝子」が原因遺伝子として見つかった。多くの遺伝性パーキンソン病の発症年齢は比較的若いという特徴があるが、LRRK2遺伝子変異によるパーキンソン病は、平均発症年齢が50歳程度と晩発性であること、臨床症状が一般的なパーキンソン病のそれと類似しているという特徴がある。またSNP解析からも、パーキンソン病のリスク遺伝子であることが証明され、パーキンソン病全体の発症原因を理解する上で重要な遺伝子であると考えられている。
遺伝子産物であるLRRK2はGTPaseドメイン、セリンスレオニンキナーゼドメインなど複数の機能ドメインをもつタンパク質。しかし、LRRK2遺伝子の変異がどのようにゆっくりと神経変性を起こすかは明らかでなかった。
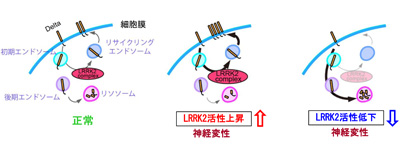
小胞輸送の異常が、加齢と共に徐々に神経変性をもたらす
今回、研究グループは、LRRK2が細胞内のシグナル伝達に関係するタンパク質であると想定し、LRRK2に結合する分子を精製した。結合分子は200以上みつかり、その中で神経の生存性へ関与する分子のスクリーニングを実施。培養細胞とショウジョウバエを用いてスクリーニングした結果、HERC2(ハーク2)、NEURL4(ニュウラル4)という2つの分子が絞り込まれたという。
HERC2は小胞輸送を制御するユビキチンリガーゼで、NEURL4 はアダプター分子と考えられ、両分子はNotchシグナルに関係するドメインを有する共通点があった。LRRK2との関係を調べた結果、HERC2、NEURL4は、LRRK2をNotchシグナル制御に向かわせる橋渡し役をしていることが判明。Notchシグナルは神経幹細胞の維持に重要なシグナル伝達経路の1つだが、成熟した神経においての役割は分かっていなかった。同研究では、ショウジョウバエ成虫脳ドーパミン神経において、神経活動に応じてNotchシグナルが活性化することを見出し、LRRK2変異によるNotchシグナルの過剰な抑制が徐々に神経変性を導くことを世界で初めて明らかにしたという。
今後は、徐々に神経変性が起こるショウジョウバエモデルを利用して、神経変性に関係するNotchシグナル下流分子を明らかにし、Notchシグナルがドーパミン神経の生存性維持にどのように関わるのか、さらなる研究をしていく予定としている。
▼関連リンク
・順天堂大学 プレスリリース






