最もハードルが高い領域の1つと考えられていた構造を解析
京都大学は5月18日、アルツハイマー病の患者脳において、老人斑の中でも特に疾患初期に蓄積すると考えられるタイプに、固有と考えられる繊維状アミロイドβタンパク質の新たな立体構造を発見したと発表した。
画像はリリースより
この成果は、同大学医学研究科の星美奈子特定准教授(先端医療振興財団客員上席研究員)とUniversity of Illinois at ChicagoのYoshitaka Ishii教授、National Cancer Institute at FrederickのRuth Nussinov主任研究員の共同研究によるもの。英科学誌「Nature Structural & Molecular Biology」電子版に。5月5日付で掲載されている。
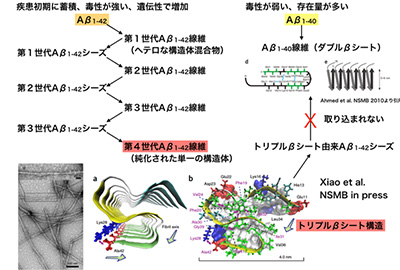
アルツハイマー病は、40から43残基の長さを持つAβペプチドが集合し、毒性を持つことで発症すると考えられている。Aβは、ペプチド自身が複数の種類があること、環境に応じてさまざまな集合体を作り、その機能が異なることから、構造解析が最も必要とされている一方で、最もハードルが高い領域の1つと考えられていた。
アルツハイマー病発症の初期過程の手がかりとなるか
今回、研究グループは、サンプル調製を工夫することで、Aβの中でも42残基のものだけが形成できる、トリプルβシートという新たな立体構造を、固体NMRによって明らかにすることに成功。このトリプルβシート構造は、Aβ1-42だけが形成でき、Aβ1-40では形成できないだけではなく、この構造をAβ1-42に加えればこれを鋳型に同じ構造体を作るのに対して、Aβ1-40ではこの構造を鋳型にはできないことが分かったという。
この研究成果は、これまで構造生物学にとってハードルが高かった42残基Aβの繊維状凝集体に対してNMR構造解析に成功しただけではなく、アルツハイマー病の初期過程において、プリオン病で認められるような構造の伝播が、配列に依存して起きている可能性を示しており、未だほとんど解明されていないアルツハイマー病発症の初期過程に迫る手かがりを拓いた成果だと研究グループは述べている。今後は、実際に患者脳由来の試料を使って構造解析を進める予定としている。
▼外部リンク
・京都大学 プレスリリース




